光毒性,顾名思义,就是光带来的毒性。像日常生活中的太阳会晒黑甚至晒伤我们的皮肤,就是光毒性的一种。在活体成像中,荧光成像产生的光毒性会造成活体组织或细胞产生损伤的情况,需尽量避免。本文主要从以下几方面来介绍活细胞成像中的光毒性。
1. 为什么要减少光毒性
过量光照对活细胞有多种损伤,进而影响细胞的代谢,运输,有丝分裂等一系列过程,最终影响实验结果。甚至产生完全错误的结论。
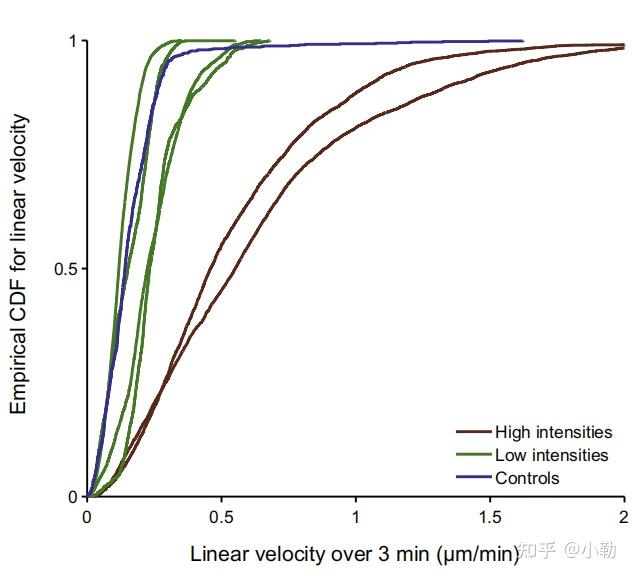
如图1的研究中,对于活细胞内的运输过程,Tinevez等人发现细胞内的某种运输过程似乎是主动运输,后通过调节不同的荧光激发光强度发现,是高光照导致了被动扩散过程变成了主动运输过程。由此可见光毒性会让实验产生错误的结果,进而影响实验重复性,而重复困难是很多活体成像实验的难题之一。
2. 产生光毒性的原因
光毒性的主要原因是活性氧(ROS)的影响,也有如紫外线造成DNA碱基对二聚化和红外线造成局部过热 对活细胞造成损伤的影响。活性氧天然存在于活细胞中的有机分子,如黄素和卟啉,吸收可见波长的光,与氧气发生反应时会降解产生ROS。一般活细胞体内有自己的调节方式,会让活性氧参与到细胞内代谢过程中,同时不至于产生毒害作用。但激发荧光团会在三线态过程中产生活性氧ROS。
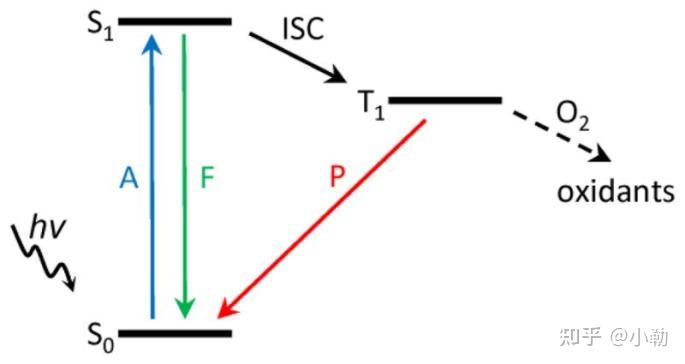
在光照 (hv) 时,基态 (S 0 ) 的光敏剂可以吸收光 (A,蓝色) 并转变为激发单重态 (S 1 )。S 1中的光敏剂可以通过热量或荧光(F,绿色)形式的能量损失返回到 S 0能量。从 S 1开始,光敏剂也可以通过系统间穿越 (ISC) 发展为寿命相对较长的激发三重态 (T 1 )。然后光敏剂可以通过磷光(P,红色)返回基态。或者,在氧气 (O 2 ) 存在下,T 1可以通过I型或II型过程产生氧化剂。
简单来说,在荧光发生过程中,被激发的荧光分子并不完全都会从激发态返回到基态产生荧光,有部分会进入到三线态(T1)的状态,在这个过程中会产生活性氧。因此越容易进入三线态的染料,就越容易造成ROS的生成,导致光毒性严重。
在生物学实验中经常利用紫外光UV进行“DNA损伤实验”,因为紫外光可造成DNA碱基二聚化,进而影响DNA的正常复制合成。因此活细胞成像要避免使用紫外光激发的染料。红外线波段的染料相对来说更安全,也有双光子这类成像设备利用红外线穿透深度高的优势进行活体深度成像,但是高强度的红外信号会产生局部过热,直接对活体组织细胞造成物理性损伤。
从上可见,无论紫外,红外还是可见光范围都可能对活体组织细胞造成影响,相对来说,激发波长越长的荧光染料对活体组织的影响越小,但不是完全没有。上述光照产生的影响进一步对细胞内稳态,如pH、钙、cAMP、ATP、粘度和氧化还原电位有促进或不利的影响,扩大了光毒性的影响范围。
3. 光毒性的特点
光毒性具有很多有趣的特点,例如,未进行荧光标记的细胞,在荧光激发光照射下并不会产生强烈的光毒性——当然紫外光除外。只有标记了荧光信号,然后被激发的情况下才有产生光毒性的基础,因为荧光被激发后才有可能产生ROS。以及“波长越长对活细胞的影响越小”,因为相对紫外和靠近蓝色波段的光,越靠近红色波段的光,光毒性越小。但要注意,研究一些关键细胞器或膜结构时,例如线粒体,要特别注意光毒性的问题,因为ROS对这些结构的影响更大,更容易导致细胞死亡。
此处我们需要讨论一个容易混淆的问题,就是光毒性和光漂白之间相关但不完全一致。光漂白代表激发光导致荧光信号淬灭的过程,是由高强度光照和/或长时间光照引起的。而光毒性代表光照直接或间接影响细胞代谢、信号传导、组织发育等,是成像生物/细胞受损的过程。一般来说发生光漂白的过程中都伴随着光毒性,但是发生光毒性时不一定发生光漂白,也就是说光漂白是光毒性充分不必要条件!此外还有活体细胞会随着发育不断合成新的荧光蛋白,所以仅从光漂白上来判断光毒性也是不确定的。还有一些光毒性发生只需要很弱的光照就可以产生,并没有明显的光漂白发生,这主要是因为不同的组织细胞对光的敏感度不同,而且不同的荧光蛋白的光毒性产生难易程度也不同。
4. 光毒性的检测
由于光毒性不能和光漂白简单画等号,因此需要一些实验方法来判断是否发生光毒性。一般来说光毒性可以通过以下几种方法来判断:细胞形态学变化,标准样品检测,细胞增殖实验,细胞代谢减少等等。常见的方法如细胞形态学变化,因为细胞凋亡会出现明显的:皱缩,变圆,空泡化,出泡等形态。这意味着细胞进入了凋亡过程。但是,很多光毒性的影响并不会出现明显的凋亡形态,影响会更隐秘一些。
因此简单用形态学的变化并不能完整的描述光毒性对活体成像的影响,所以可以通过统计如细胞分裂数量,有丝分裂时间等等,将这些变化总结为与强度相关的曲线图——光毒性剂量反应曲线,可以帮助研究人员判断光毒性发生的影响和强度阈值在哪里。
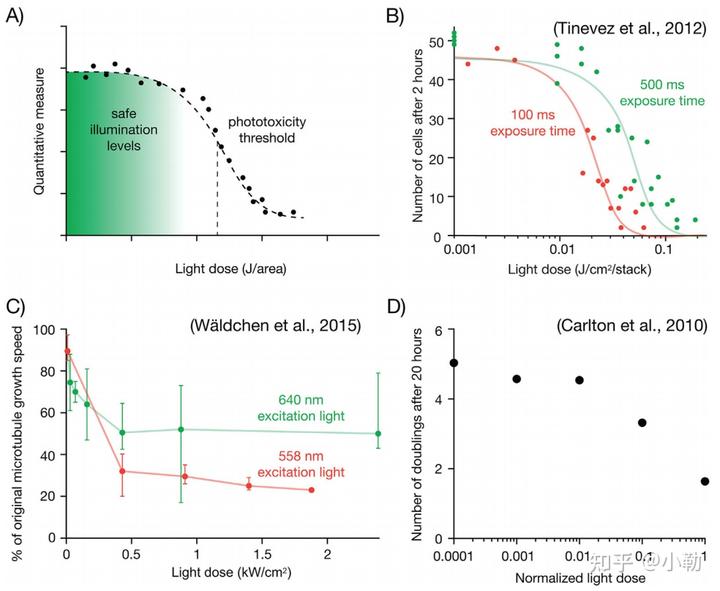
对于成像时间较短的活细胞或者活组织而言,可能光毒性在实验成像阶段并没有体现,但是并不意味着不受光毒性的影响,最佳的判断光毒性方法是在实验结束后进行一段时间的持续的检测,例如使用明场或者相差一类温和的照明方式,来观察细胞能否继续健康的生长。
5. 如何减少光毒性
了解了光毒性的特点和检测方法,下面我们要讨论一下如何减少其影响。减少光毒性的核心在于减少作用在活体样品上的光剂量。光剂量等于激发光的强度与曝光时间的乘积,简言之,光强度越高,曝光时间越长,光剂量越高。因此围绕减少光强度和缩短曝光时间来进行优化活体成像的方法多种多样。
首先,对于荧光蛋白来说,不同的荧光蛋白的特性不同,主要通过光稳定性,光敏感性和亮度这几个维度来选择。光稳定性越高,光敏感性越低,亮度越高,这样的荧光蛋白更适合活体成像。不过这种理想化的实验很难遇到,而且面对不同的实验目的,样品和条件,荧光蛋白的性质也会发生变化。
5.1. 荧光蛋白的选择
因为不同的荧光蛋白的光稳定性和光敏感性不同,会造成显著的光毒性差异。一般研究人员在选择荧光蛋白时,往往只注意了亮度这个维度,实际上光稳定性和光敏感性才是更重要的因素。因为光稳定性决定了荧光蛋白的光漂白程度,而光敏感性则与其产生光毒性程度相关。
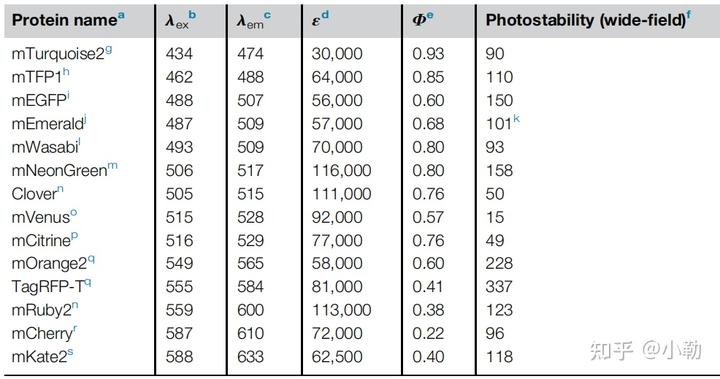
上表所示,不同荧光蛋白具有不同的激发和发射峰。ε×Φ等于荧光蛋白的亮度,Photostability代表其稳定性。可以看见虽然mVenus的亮度相比mEGFP要高许多,但是光稳定性上后者是前者的十倍,也就是说mVenus在相同激发光强度下更容易被漂白。而且还要注意的是对于光稳定性:不同荧光蛋白不同,体内外不同,不同生物体不同。需要因地制宜,根据实际实验条件和要求来选择荧光蛋白。
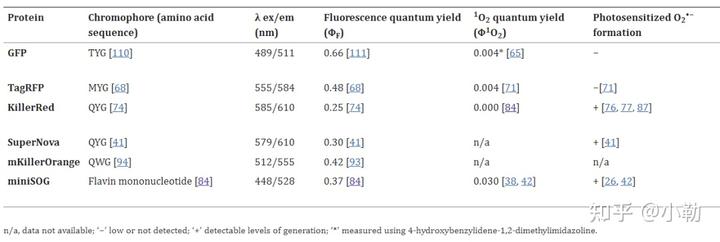
光敏感性代表了荧光蛋白产生活性氧ROS的效率,因此ROS的产率越高则光毒性可能越强。上表举例活细胞常用的GFP和TagRFP与细胞损伤性荧光蛋白相比,其产生活性氧的效率更低,因此更适合活体成像。而像KillerRed这类的荧光蛋白,他们主要应用在肿瘤细胞杀伤性实验中,因此需要更高的ROS产率。
最后还要再次强调荧光蛋白波长的选择,在原理部分我们介绍过,紫外容易造成DNA损伤,虽然红外也会产生局部过热,但是相对紫外光,红外只要控制好光强度,对样品的保护还是更好一些。所以一般会认为波长越靠近红外波段,对样品的光毒性越小。
5.2. 成像参数的选择
活体成像一般会采用间歇式的照明方式,即成像一幅图像或一个完整的3D结构后,暂停照明,停顿一段时间后再打开光源继续成像。这样循环成像能够减少激发光持续照射样品。还可以选择减少光强或增加曝光时间:可以减小照射光的峰值,有利于减少光毒性,但是后者会降低成像速度。
越来越多的近红外染料应用在荧光活体成像中,而早期的成像设备大多也是为可见光范围优化的,使用这些设备做近红外成像光效率偏低,因此选择一个对近红外成像优化的成像设备,也是很重要的方面。
要注意成像光路中物镜的选择,因为进光量与物镜倍数成反比,但是与物镜的NA值(数值孔径)成正比。因此在相同倍数的物镜下尽量选择高NA值;在NA值相同的情况下,选择倍数较低的物镜,都能降低作用于样品的光剂量。
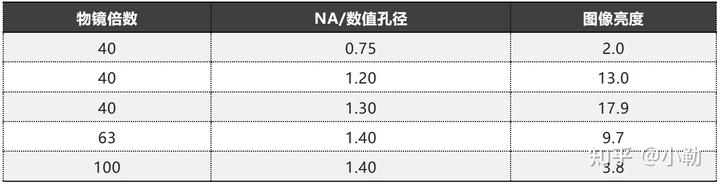
在成像中如果样品荧光偏弱,那么在使用共聚焦成像时,适当的放大针孔,虽然会影响分辨率,但是能够提高图像的亮度,减少激发光。在进行3D成像时,适当的层与层间隔,也能减少总成像时间,从而减少整体的光漂白效率。
通过添加活性氧清除剂可以减少光毒性的影响,例如抗坏血酸和类黄酮芦丁,但是需要注意的是,它们作用有限,并不能完全抑制活性氧的生成。
还有很重要但是容易被忽视的一点,就是目镜观测造成的光毒性问题,经过测算,目镜下观察样品和实际成像时,两者在样品上的激发光强度可能差距超过100倍!因此减少或者使用非荧光方式观察样品,也是减少光毒性的关键。

参考文献
1. Peng, X., Huang, X., Du, K., Liu, H. & Chen, L. High spatiotemporal resolution and low photo-toxicity fluorescence imaging in live cells and in vivo. Biochem Soc Trans 47, 1635–1650 (2019).
2. Laissue, P. P., Alghamdi, R. A., Tomancak, P., Reynaud, E. G. & Shroff, H. Assessing phototoxicity in live fluorescence imaging. Nat Methods 14, 657–661 (2017).
3. Icha, J., Weber, M., Waters, J. C. & Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. Bioessays 39, (2017).
4. Cutrale, F. et al. Hyperspectral phasor analysis enables multiplexed 5D in vivo imaging. Nat Methods 14, 149–152 (2017).



